肺鳞癌占非小细胞肺癌(NSCLC)新发病例的30%左右。肺鳞癌相比肺腺癌治疗的效果较差,治疗方案选择较少,肺鳞癌具有独特的流行病学,临床病理学和分子学特征,如与吸烟密切相关,EGFR突变率、ALK的重排率较低等等,导致肺鳞癌靶向治疗效果往往不佳。近几年,免疫治疗在肺鳞癌取得诸多突破,为肺鳞癌患者长期生存带来希望。本文将从化疗、免疫治疗、靶向治疗三个方面详细介绍当前肺鳞癌的治疗[1]。
 2022CSCO指南
2022CSCO指南 
肺鳞癌篇概要
全身化疗
一线化疗
1. ECOG1594研究:吉西他滨+铂类,奠定吉西他滨作为肺鳞癌一线化疗
2. JMDB研究:培美曲塞不适宜用于肺鳞癌患者
3. WOG5208L、JUST研究:多西他赛+奈达铂 vs 多西他赛+顺铂,不能耐受顺铂/卡铂,可选奈达铂
4. CA031研究:白蛋白结合型紫杉醇/卡铂vs 紫杉醇/卡铂,nab-PC组降低不良反应
5. 三项研究:对于“PS 2分/老年患者”,双药更优、但副作用更大,可考虑使用非含铂方案或者单药治疗
维持化疗
6. 两项研究:同药维持(吉西他滨)可以延长PFS
7. 一项III期研究:换药维持(多西他赛)可以延长PFS
二线化疗
8. TAX320研究:多西他赛 vs 长春瑞滨或异环磷酰胺,延长OS
9. J-AXEL研究:白蛋白紫杉醇 vs 多西他赛,白紫不劣于多西他赛
10. Tempo-Lung研究:长春瑞滨软胶囊,节拍化疗 vs 标准给药,节拍化疗有效且安全
11. 一项III期临床研究:S-1不劣于多西他赛,可以作为不耐受其他治疗的替代选择
免疫治疗
一线治疗
免疫单药
12. KEYNOTE-024研究:PD-L1≧50%,K药vs化疗,生存获益
13. KEYNOTE-042研究:PD-L1≧1%,K药vs化疗,生存获益
14. CheckMate 026研究:PD-L1≥1%,O药vs化疗, OS失利
15. IMpower110研究:PD-L1高表达,T药vs化疗,生存获益
免疫+化疗/免疫
16. KEYNOTE-407研究:K药+化疗 vs 化疗,生存获益
17. IMpower131研究:T药+化疗 vs 化疗,鳞癌一线失利
18. CameL-sq研究:卡瑞丽珠单抗+化疗 vs 化疗,PFS延长
19. RATIONALE307研究:替雷利珠单抗+化疗 vs 化疗,PFS延长
20. ORIENT-12研究:信迪利单抗+GP vs 化疗,PFS延长
21. GEMSTONE-302研究:舒格利单抗+化疗 vs 化疗,PFS延长
22. CheckMate 227研究:O药+Y药,生存获益
二线治疗
23. CheckMate017研究:O药vs多西他赛,生存获益
24. CheckMate078(中国数据):O药vs多西他赛,生存获益
25. KEYNOTE-010研究:PD-L1≧1%,K药vs多西他赛,生存获益
26. OAK & POPLAR研究:T药 vs 多西他赛,生存获益
靶向治疗
27. EGFR/ALK阳性很低,接受靶向治疗机会小
28. ALTER0302&ALTER0303研究:三线,安罗替尼 vs 安慰剂,生存获益
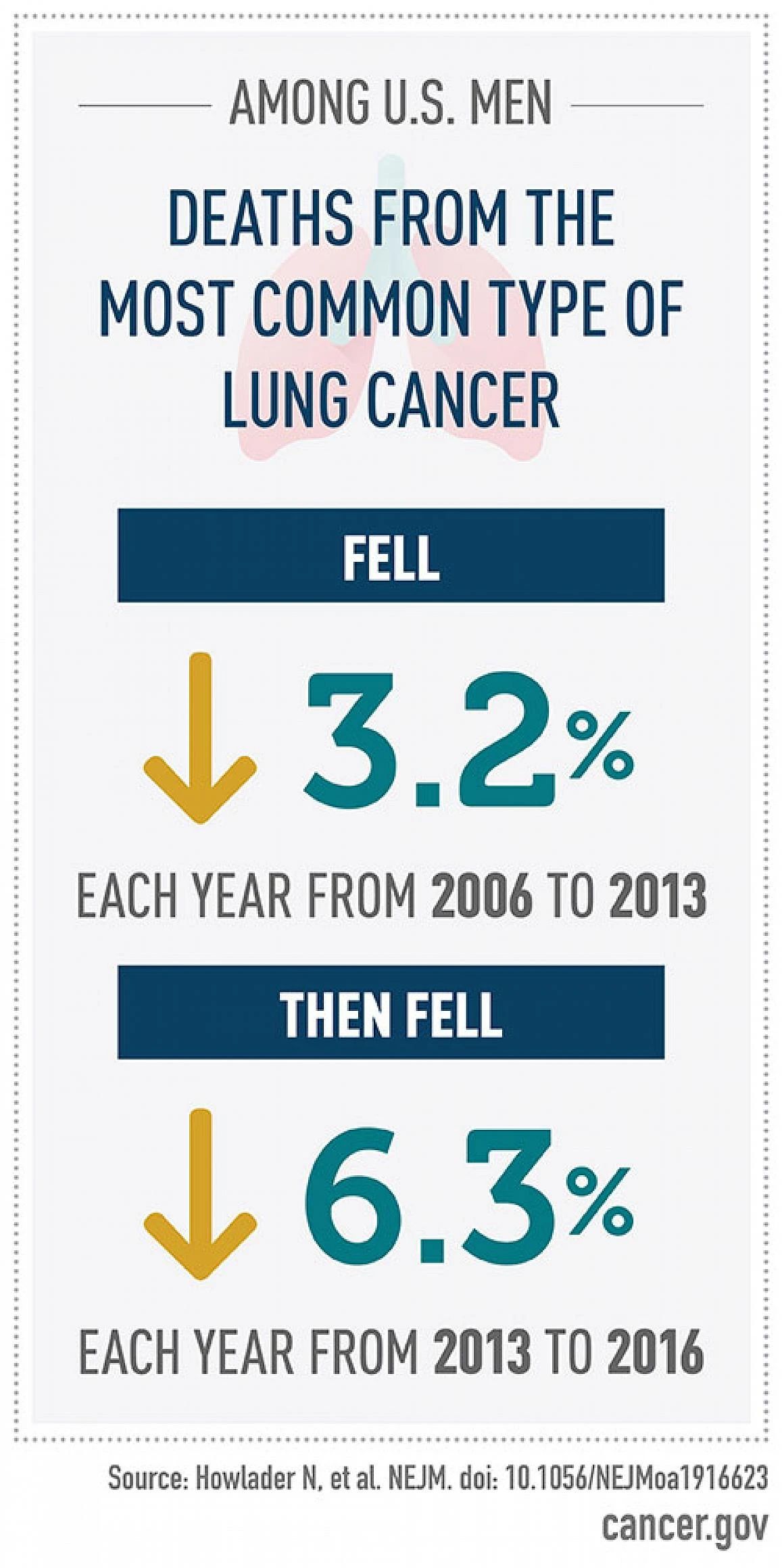
晚期系统化疗 绝大部分肺鳞癌无明确驱动基因,因此即使在TKI改变肺癌治疗模式的时代,化疗仍在晚期肺鳞癌的治疗中有着不可替代的地位。含铂双药方案是驱动基因阴性肺鳞癌的标准治疗。 一线化疗 吉西他滨+铂类ECOG1594研究[2]:是第一项比较第三代化疗药物联合铂类一线治疗非小细胞肺癌(NSCLC)疗效的临床研究,其结果奠定了吉西他滨作为肺鳞癌一线治疗标准化疗药物的地位。研究结果显示吉西他滨、紫杉醇、多西他赛联合铂类一线治疗NSCLC疗效相近,但在鳞癌亚组(288例),吉西他滨联合顺铂(GP)方案相比其他方案,无进展生存期(PFS)和总生存期(OS)最长,分别是4.4个月和9.4个月。就是说有一半接受吉西他滨+顺铂化疗的肺鳞癌患者其肿瘤可以维持不进展状态至少4.4个月,生存期至少9.4个月。

 JMDB研究[3]:是一项比较吉西他滨+顺铂和培美曲塞+顺铂一线治疗非小细胞肺癌的大型临床研究,共纳入1725例未经化疗的晚期非小细胞肺癌患者,在总体人群中吉西他滨+顺铂组和培美曲塞+顺铂组中位总生存期均为10.3个月,但在鳞癌亚组,吉西他滨+顺铂较培美曲塞+顺铂组中位PFS(5.5个月vs 4.4个月)和OS(10.8个月vs 9.4个月)均显著延长。培美曲塞虽是一种很好的化疗药物,但培美曲塞不适宜用于肺鳞癌患者。 用法用量:1、吉西他滨通常联合顺铂,剂量为吉西他滨1000-1250mg/m2表面积,第1,第8天静脉滴注;顺铂75-80mg/m2表面积,第1天或分3天静脉滴注,上述药物21天为一个治疗周期,视患者情况一般化疗4-6周期。2、顺铂也可以更换为卡铂,剂量为AUC 5,疗效与顺铂无明显差异,但胃肠道不良反应较顺铂轻,而骨髓抑制则较顺铂重。3、如果患者体力状态较好,吉西他滨+铂类化疗后不但肿瘤缩小至少30%,而化疗副作用耐受良好的话可以去掉铂类化疗,只选择吉西他滨单药进行后续维持化疗,有望可以进一步延长患者生存期。吉西他滨维持化疗剂量为1000mg/m2表面积。 多西他赛+铂类 WOG5208L研究[4](日本):一项来自日本的“奈达铂+多西他赛”对比“顺铂+多西他赛”一线治疗晚期肺鳞癌的研究。结果显示奈达铂组较顺铂组的生存略有优势[中位总生存期(overallsurvival, OS)13.6个月 vs 11.4个月,HR=0.81(95%CI: 0.65-1.02),P=0.037],奈达铂组降低3级以上非血液学毒性发生率(包括恶心、乏力、低钠血症和低钾血症等)的同时增加了3级以上血液学毒性发生率(包括白细胞减少、中性粒细胞减少及血小板减少)。
JMDB研究[3]:是一项比较吉西他滨+顺铂和培美曲塞+顺铂一线治疗非小细胞肺癌的大型临床研究,共纳入1725例未经化疗的晚期非小细胞肺癌患者,在总体人群中吉西他滨+顺铂组和培美曲塞+顺铂组中位总生存期均为10.3个月,但在鳞癌亚组,吉西他滨+顺铂较培美曲塞+顺铂组中位PFS(5.5个月vs 4.4个月)和OS(10.8个月vs 9.4个月)均显著延长。培美曲塞虽是一种很好的化疗药物,但培美曲塞不适宜用于肺鳞癌患者。 用法用量:1、吉西他滨通常联合顺铂,剂量为吉西他滨1000-1250mg/m2表面积,第1,第8天静脉滴注;顺铂75-80mg/m2表面积,第1天或分3天静脉滴注,上述药物21天为一个治疗周期,视患者情况一般化疗4-6周期。2、顺铂也可以更换为卡铂,剂量为AUC 5,疗效与顺铂无明显差异,但胃肠道不良反应较顺铂轻,而骨髓抑制则较顺铂重。3、如果患者体力状态较好,吉西他滨+铂类化疗后不但肿瘤缩小至少30%,而化疗副作用耐受良好的话可以去掉铂类化疗,只选择吉西他滨单药进行后续维持化疗,有望可以进一步延长患者生存期。吉西他滨维持化疗剂量为1000mg/m2表面积。 多西他赛+铂类 WOG5208L研究[4](日本):一项来自日本的“奈达铂+多西他赛”对比“顺铂+多西他赛”一线治疗晚期肺鳞癌的研究。结果显示奈达铂组较顺铂组的生存略有优势[中位总生存期(overallsurvival, OS)13.6个月 vs 11.4个月,HR=0.81(95%CI: 0.65-1.02),P=0.037],奈达铂组降低3级以上非血液学毒性发生率(包括恶心、乏力、低钠血症和低钾血症等)的同时增加了3级以上血液学毒性发生率(包括白细胞减少、中性粒细胞减少及血小板减少)。 
WOG5208L研究

JUST研究
JUST研究[5](中国):针对奈达铂副作用明显的特点,由中国学者主持的JUST研究对比WOG5208L研究,在治疗方案上主要在多西他赛和奈达铂的剂量上进行了调整。该研究共纳入了286例晚期肺鳞癌患者。治疗方案上,多西他赛用量增加15mg/m2,奈达铂剂量减少了20mg/m2。该研究的主要研究终点为PFS,研究结果表明,实验组与对照组无明显差异:PFS 4.63个月(95%CI: 4.43-5.10) vs 4.23个月(95%CI: 3.37-4.53)[HR=0.778 (90%CI:0.599-1.009), P=0.056,4],奈达铂组降低了3级以上非血液学毒性(包括恶心呕吐和肌酐异常)和部分血液学毒性(贫血)反应的发生率,但其3级以上血小板减少发生率仍高于对照组。因此对于不能耐受顺铂或卡铂的患者,奈达铂可作为晚期肺鳞癌患者一线治疗的另一个选择。 紫杉醇类+铂类 CA031研究[6]:除了铂类以外的化疗药物也在进行探索,白蛋白紫杉醇联合卡铂对比紫杉醇联合卡铂一线治疗的III期研究鳞癌亚组中,白蛋白紫杉醇组的客观缓解率(objective response rate, ORR)高于对照组[41% vs24%,缓解比值比(odds ratio, OR)=1.680(95%CI: 1.271-2.221),P<0.001],该方案也可以作为肺鳞癌晚期一线方案[在晚期肺鳞癌中能提高缓解率,却没有赢得PFS及OS,但不良反应降低]? PS 2分/老年患者 对于体力评分差的患者,单药化疗是标准治疗,联合化疗要结合具体情况权衡毒性与获益;对于老年患者,联合方案的疗效获益与毒性伴行,需全面评估一般状况、器官功能及伴随疾病等因素。 一项III期临床研究[7]:针对PS 2分的晚期非小细胞肺癌患者,对比了紫杉醇联合卡铂方案与吉西他滨或长春瑞滨单药治疗的疗效与安全性。虽然双药联合组的TTP较单药组有优势(4.6个月 vs3.5个月,P<0.001),但中位OS并无统计学差异(8.0个月 vs 6.6个月,P=0.184),同时双药联合组的3级-4级毒性反应发生率高于单药组(40%vs 22%)。 MILES研究[8]:对比了吉西他滨联合长春瑞滨和吉西他滨或长春瑞滨单药在老年(≥70岁)NSCLC患者中的疗效,结果显示:联合化疗组较单药组无生存获益。 IFCT-0501研究[9]:对比了紫杉醇联合卡铂(紫杉醇每周给药,卡铂每月给药)和吉西他滨或长春瑞滨单药治疗老年NSCLC的III期研究。联合化疗组较单药组取得了明显的中位OS获益[10.3个月 vs 6.2个月,HR=0.64(95%CI: 0.52-0.78),P<0.000,1]。同时联合化疗组3级-4级血液学毒性、乏力和感觉神经毒性也相应增加。 维持化疗 维持治疗是一线化疗后没有进展患者的一个选择,对于体力状态好的患者,诱导化疗后维持治疗能进一步改善生存。 同药维持(吉西他滨) 一项III期临床试验[10]:一线吉西他滨联合顺铂诱导化疗后单药吉西他滨维持治疗组对比最佳支持治疗组显著延长了至疾病进展时间(time to progression, TTP)(3.6个月 vs 2.0个月,P<0.001),在基线行为状态评分(Karnofsky performance status, KPS)>80分的患者有明显的总生存获益[中位OS 25.3个月 vs 12.2个月,HR=2.1(95%CI: 1.2-3.8)]。IFCT-GFPC 0502研究[11]:该研究为了排除二线治疗方案对维持治疗生存获益的影响,将研究组与对照组二线治疗统一为力比泰方案。吉西他滨联合顺铂诱导化疗后单药吉西他滨维持治疗组较观察组显著延长了PFS[3.8个月 vs 1.9个月,HR=0.56(95%CI: 0.44-0.72),P<0.001]。
换药维持(多西他赛)一项III期临床研究[12]:一线吉西他滨联合顺铂化疗后即给予多西他赛维持治疗组较疾病进展后二线给予多西他赛治疗组PFS显著延长(5.7个月 vs 2.7个月,P=0.000,1),中位OS也有获益趋势(12.3个月 vs 9.7个月,P=0.085,3)。因此一线吉西他滨联合铂类诱导化疗后疾病控制有效且KPS评分较好的患者,可行吉西他滨单药维持治疗,换药维持的选择包括多西他赛。特殊患者如体能状态(performance status, PS)2分及老年患者的治疗需要慎重权衡获益与毒性后进行选择。
二线化疗晚期肺鳞癌的二线治疗可选方案除了多西他赛或吉西他滨单药,还有长春瑞滨、异环磷酰胺,S-1也在东亚患者验证了二线相比于多西他赛的非劣效性,可以作为不耐受其他治疗的替代选择。
TAX320研究[13]:一项针对一线含铂方案化疗后疾病进展的晚期NSCLC患者的III期随机临床研究。结果显示多西他赛组的有效率高于长春瑞滨和异环磷酰胺[10.8% vs 6.7% vs 0.8%,多西他赛(D)100 mg/m2 vs 长春瑞滨或异环磷酰胺(V/I),P=0.001;D 75mg/m2 vs V/I P=0.036;D vs V/I,P=0.002];另外尽管三组的总生存未见统计学差异,但D75组的1年生存率优于对照组(32% vs 19%,P=0.025)。 J-AXEL研究:是日本学者开展一项多中心、随机、开放、非劣效性的III期临床试验,旨在评估nab-紫杉醇对比多西他赛治疗含铂化疗失败的NSCLC患者的疗效和安全性。结果显示nab-紫杉醇不劣于多西他赛。 JTO丨非小细胞肺癌二线治疗,白蛋白紫杉醇不劣于多西他赛 Tempo-Lung研究[14]:是一项多中心、前瞻性、随机、开放标签Ⅱ期研究,对比了两种口服化疗模式:长春瑞滨软胶囊节拍化疗 vs 长春瑞滨标准给药方式用于不适合含铂化疗方案的晚期NSCLC一线治疗。研究共纳入167例患者,分配至节拍化疗组(50mg,每周D1、3、5)和标准给药组(每周给药60-80 mg/m2 ),直至疾病进展或出现不可接受的毒性。无4级毒性的无进展生存期为4.0 vs 2.2个月(HR=0.63,95%CI:0.45~0.88,P=0.0068);PFS 分别为 4.3 vs 3.9 个月,没有观察到中位 OS 的差异(7.1和7.6个月)。节拍化疗组3-4级治疗相关不良事件发生率较低(25.3% 对 54.4%)。 一项III期临床研究[15]:2017年发表的日本一项S-1对比多西他赛治疗含铂化疗失败的NSCLC的III期研究中(东亚S-1研究)入组了60.1%-62.7%的日本患者,33.4%-33.7%的中国患者,结果显示S-1对比多西他赛显示出非劣效性,中位OS分别为12.75个月 vs12.52个月(HR=0.945,95%CI: 0.833-1.073, P=0.381,8)。中位PFS也无明显差异(HR=1.033, 95%CI: 0.913-1.168),ORR分别为8.3% vs 9.9%。S-1组的不良反应以消化道为主,多西他赛不良反应以血液学为主。研究中鳞癌患者占17%-18.2%,在鳞癌亚组OS的HR为0.883(95%CI: 0.657-1.186),相比于腺癌患者HR=1.008(0.870-1.167),似乎更能从S-1的治疗中获益,而且S-1作为口服药物,相比于静脉给药更具便利性。 免疫治疗 一线治疗 免疫单药 在晚期肺鳞癌的一线治疗探索中,KEYNOTE-024、KEYNOTE-042、CheckMate 026和MYSTIC研究均在经过免疫标志物筛查的人群中采用了单药对比化疗的研究设计,区别在于PD-L1表达筛选标准不同。

晚期肺鳞癌免疫单药治疗研究
KEYNOTE-024研究[16]:对于PD-L1表达比例≥50%的晚期NSCLC初治患者,单药pembrolizumab组较含铂双药化疗组显著提高有效率(44.8% vs 27.8%),明显改善PFS[10.3个月 vs 6.0个月,HR=0.50(95%CI: 0.37-0.68),P<0.001],其中,鳞癌亚组的PFS改善尤为显著(HR=0.35, 95%CI: 0.17-0.71)。再者,免疫治疗组比化疗组的6个月总生存率更高[80.2% vs 72.4%, HR=0.60 (95%CI: 0.41-0.89), P<0.005],3级-5级治疗相关不良反应(TRAE)发生率明显低于化疗组(26.6% vs 53.3%),pembrolizumab组最常见的3级-5级不良反应为皮肤毒性、肺炎及结肠炎。 KEYNOTE-042研究[17]:入组标准将PD-L1表达比例降低到≥1%,仍然取得了阳性结果。研究中根据肿瘤细胞阳性比例分数(tumor proportion score, TPS)分成不同亚组,在各个亚组中,Pembrolizumab均较标准化疗有总生存的优势(TPS≥50%: HR=0.69, 95%CI: 0.56-0.85, P=0.000,3; TPS≥20%: HR=0.77, 95%CI: 0.64-0.92, P=0.002,0; TPS≥1%: HR=0.81, 95%CI: 0.71-0.93, P=0.001,8)。在TPS≥1%的鳞癌亚组中HR=0.75(0.60 - 0.93),与总体人群获益趋势一致。CheckMate-026研究[18]:是一项开放标签、随机分组Ⅲ期研究,主要考察一线使用nivolumab与研究者选择的化疗方案在晚期NSCLC患者中的疗效差异。但研究结果表明,nivolumab一线治疗晚期NSCLC对比传统化疗在PFS、OS方面并未取得优势。
IMpower110研究[19]:是一项阿替利珠单抗单药(1200mgq3w)对比铂类为基础的化疗(非鳞癌培美曲塞+卡铂/顺铂,鳞癌吉西他滨+卡铂/顺铂)一线治疗PD-L1阳性转移性NSCLC的3期研究。纳入了572名TC或IC的PD-L1≥1%(使用SP142)鳞癌及非鳞癌患者,研究主要终点是排除EGFR突变或ALK易位患者,并且根据PD-L1选择的人群的总生存期。

2020WCLC公布最新结果:数据截止2020年2月4日,中位随访31.3个月,在高PD-L1表达的WT组中,1)OS:阿替利珠单抗组vs化疗组的中位OS为20.2个月(n=107) vs 14.7个月(n=98);6个月OS率分别为76.5% vs. 70.4%;12个月OS率分别为66.1% vs. 52.3%(HR=0.76;95%CI:0.54-1.09)。2)PFS:替利珠单抗组vs化疗组的中位PFS为8.2 vs 5.0个月;6个月PFS率分别为60.3% vs. 38.3%;12个月PFS率分别为39.2% vs. 19.2% (HR=0.59;95%CI:0.43-0.81;P=0.0010)。3)ORR/DOR:阿替利珠单抗组的确认ORR为40.2%,化疗组为28.6%,两组的中位DOR分别为38.9个月vs. 8.3个月。IMpower110研究更新后的安全性分析与最初分析结果一致,在较长的随访中没有观察到阿替利珠单抗新的安全信号。





晚期肺鳞癌免疫联合治疗研究
KEYNOTE-407研究[20]:卡铂+紫杉醇/白蛋白紫杉醇联合Pembrolizumab较单纯化疗明显改善了生存,中位OS 15.9 个月 vs 11.3 个月(HR=0.64, 95%CI: 0.49-0.85, P<0.001)。中位PFS 6.4个月 vs 4.8个月(HR=0.56, 95%CI: 0.45- 0.70, P<0.001)。两组不良反应发生率类似,联合组69.8% vs 对照组68.2%,联合组因不良反应停药的比例更高(13.3% vs 6.4%)。
IMpower131研究[21]:获得了总体阴性的研究结果。atezolizumab联合卡铂/白蛋白紫杉醇对比卡铂/白蛋白紫杉醇的OS未达到统计学差异,ITT人群的中位OS为14.2个月(95%CI: 12.3-16.8) vs 13.5个月(95%CI: 12.2-15.1),HR=0.88(95%CI: 0.73-1.05),P=0.158,1。但是在PD-L1高表达或TC3/IC3的亚组中可见atezolizumab联合化疗的OS优势,23.4个月(95%CI: 17.8-NE) vs 10.2个月(95%CI: 7.1-17.5),HR=0.48(95%CI: 0.29-0.81),但这一亚族样本量仅有91例,谨慎看待阳性结果。 CameL-sq研究[22]:评估了卡瑞利珠单抗联合卡铂和紫杉醇一线治疗晚期或转移性鳞状NSCLC的有效性和安全性。联合治疗组和单药单纯化疗组PFS分别为8.5个月和4.9个月,HR=0.37,P<0.001。无论患者PD-L1表达水平,患者均可获益;PD-L1表达小于1%和大于1%的患者,HR分别为0.49和0.34。2022ELCC会议,联合化疗组显著延长了患者的OS[27.4 vs 15.5个月( HR=0.57,P <0.0001)]。安全性:两组3度及以上治疗相关不良反应发生率分别为73.6%和71.9%,未出现非预期的不良反应。 RATIONALE307研究[23]:评估替雷利珠单抗联合紫杉醇/白蛋白紫杉醇和卡铂对比紫杉醇联合卡铂一线治疗晚期鳞状NSCLC的疗效和安全性。360名晚期鳞状NSCLC患者被随机分配,A组替雷利珠单抗+紫杉醇/卡铂,B组替雷利珠单抗+白紫/卡铂,C组紫杉醇/卡铂。在A组、B组、C组中,PFS分别为7.6 vs 7.6 vs 5.5个月。 ORIENT-12研究[24]:评估了信迪利单抗联合吉西他滨+铂类(GP)或安慰剂联合GP一线治疗晚期或转移性鳞状NSCLC的有效性和安全性。与既往不同的是,这项研究的化疗使用了亚洲肺鳞癌人群更常用的GP方案,避开了紫杉类常引起的脱发。与安慰剂组相比,信迪利单抗组显著延长了由IRRC评估的中位PFS,分别为5.5个月和4.9个月(HR 0.536,P<0.00001)。两组的中位OS未达到。安全性方面,两组出现≥3级的不良反应发生率相似(86.6% vs 83.1%),未观察到新的安全性信号。 GEMSTONE-302研究[25]:评估了舒格利单抗联合化疗(腺癌:培美曲赛联合卡铂;鳞癌:紫杉醇联合卡铂)在转移性非小细胞肺癌(NSCLC)的一线治疗中的临床疗效和安全性。中位PFS分别为9.0个月和4.9个月(HR=0.48;95% CI=0.39~0.60;P<0.0001)。安全性方面,两组患者在治疗过程发生不良事件、3-4级治疗过程发生不良事件和致命治疗过程发生不良事件发生率方面结果相似。 CheckMate 227研究[26]:免疫联合免疫治疗一线对比标准化疗的研究,在PD-L1≥1%的患者中,Nivolumab 3 mg/kg q2w联合Ipilimumab 1 mg/kg q6w对比标准化疗(腺癌:培美曲赛联合顺铂或卡铂;鳞癌:吉西他滨联合顺铂或卡铂)获得了生存获益,中位OS 17.1个月 vs 14.9个月,HR=0.79(95%CI: 0.65-0.96),P=0.007,在PD-L1<1%的患者中Nivolumab联合Ipilimumab的生存仍较单纯化疗更优,中位OS 17.2个月 vs 12.2个月,HR=0.62(95%CI: 0 .4 8 - 0 .78),所有随机患者中,免疫联合免疫对比化疗的生存优势明显,中位OS 17.1个月 vs 13.9个月,HR=0.73(95%CI: 0.64-0.84),而在鳞癌亚组,免疫治疗的生存获益更为明显,中位OS 14.8个月 vs 9.2个月(HR=0.69),从安全性来讲,Nivolumab联合Ipilimumab的治疗相关AE发生率略低于化疗组(77% vs 82%),免疫治疗不良反应以腹泻、皮疹、乏力为主,而化疗组仍以恶心、贫血、食欲降低为主。 二线治疗 免疫单药
晚期肺鳞癌免疫单药治疗研究
免疫治疗在肺癌的探索从晚期二线开始,Nivolumab、Pembrolizumab、Atezolizumab、durvalumab四个PD-1/PD-L1抑制剂均验证了较多西他赛的优效性。
CheckMate017研究[27]:在全球人群证实了Nivolumab在晚期肺鳞癌二线治疗中较多西他赛的优效性。Nivolumab较对照组的中位OS改善3.2个月[中位OS 9.2个月 vs 6.0个月,HR=0.59(95%CI: 0.44-0.79),P<0.001]。
CheckMate017研究[28]:在中国人群证实了Nivolumab在晚期肺鳞癌二线治疗中较多西他赛的优效性。生存获益类似[中位OS 12.0个月 vs 9.6个月,HR=0.68(95%CI: 0.52- 0.90),P= 0.000,6],提高了客观缓解率(16.6% vs 4.2%, P=0.000,1),同时明显降低3级以上不良反应(10% vs 47%),且免疫治疗不良反应以皮疹、乏力为主。其中鳞癌亚组中,Nivolumab组和多西他赛组总生存期分别为12.3个月和7.9个月(HR=0.61)。
KEYNOTE-010研究[29]:研究发现晚期肺鳞癌的二线治疗中,PD-1抑制剂Pembrolizumab 10 mg/kg组和2 mg/kg组均较多西他赛组显著延长了总生存期[10 mg/kg:12.7 个月 vs 8.5个月,HR=0.61(95%CI: 0.49- 0.75),P<0.000,1;2 mg/kg:10.4个月 vs 8.5个月,HR=0.71(95%CI: 0.58-0.88),P=0.000,8],同时3级-5级不良反应发生率也明显低于对照组(16% vs 13% vs 35%)。
OAK和POPLAR研究[30-31]:对比了多西他赛和Atezolizumab单药在晚期NSCLC的二线治疗中的疗效。在OAK研究中,Atezolizumab组较多西他赛组取得了4.2个月的显著生存获益[13.8个月 vs 9.6个月,HR=0.74(95%CI: 0.63-0.87),P=0.000,4],其中鳞癌亚组中Atezolizumab总生存也优于多西他赛,中位OS 8.9个月 vs 7.7个月[HR=0.73 (95%CI: 0.54-0.98), P=0.038]。
靶向治疗 美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南推荐不吸烟或较少吸烟患者 常规进行EGFR和ALK检测,若有基因突变应首先应用相 应的TKI治疗常见。但驱动基因如EGFR突变和ALK基因重排在肺鳞癌中发生率很低【分别为约2 .7%和 1.5%-2.5%】,因此有机会接受EGFR或ALK 抑制剂治疗的患者仅占少数。 安罗替尼安罗替尼为针对肿瘤血管生成的小分子靶向药,其主要靶点包括:VEGFR、PDGFR、FGFR。该药物于2007年完成研发至2017年获得CDE报批,已成为晚期肺鳞癌三线治疗的重要分子靶向药物。
ALTER0302研究[32]:一项安慰剂对照、随机、双盲、多中心II期临床试验,旨在明确安罗替尼用于复发性晚期NSCLC三线及以上的治疗效果和安全性。研究纳入117例至少接受过二线方案治疗的复发性IIIb期/IV期肺鳞癌或肺腺癌患者,PS 0分-2分,随机分配给予安罗替尼或安慰剂治疗。结果显示,安罗替尼组患者(n=60)的PFS(4.8个月 vs 1.2个月,HR=0.32,P<0.000,1)与ORR(10.0% vs 0%,P=0.028)均显著优于安慰剂组(n=57),但两组的中位OS无显著差异(9.3个月 vs 6.3个月;HR=0.78,P=0.231,6)。
ALTER0303研究[33]:后续开展的III期临床试验,共437例患者接受随机分配并完成了研究治疗。总体人群数据显示,相比安慰剂组,安罗替尼组(n=294)的中位OS延长3.3个月(9.6个月 vs 6.3个月,HR=0.68,P=0.001,8);中位PFS延长4.0个月(5.4个月 vs 1.4个月,HR=0.25,P<0.000,1)。安罗替尼组的ORR(9.2% vs 0.7%, P<0.000,1)和DCR(81.0% vs 37.1%,P<0.000,1)等次要终点也均显著优于对照组。安罗替尼在研究中最常见的≥3级不良反应是高血压和低血钠症。
小结:II期及III期临床研究中纳入了非中央型/空洞性肺鳞癌,虽然比例仅有10%-23%,III期研究的鳞癌亚组(N=101)观察到PFS的改善[HR=0.37 (95%CI: 0.22- 0.60)],OS的获益趋势与总体人群一致 [HR=0.73 (95%CI: 0.45-1.18), P=0.19]。因此CSCO指南也将安罗替尼纳入到晚期驱动基因阴性肺鳞癌指南中,用于外周型鳞癌的三线治疗。
参考资料
[1]高鸣,周清.晚期肺鳞癌治疗进展[J].中国肺癌杂志,2020,23(10):866-874.
[2]Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer. N Engl J Med. 2002 Jan 10;346(2):92-8. doi: 10.1056/NEJMoa011954.
[3]Scagliotti GV, Parikh P, von Pawel J,et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin pluspemetrexed in chemotherapy-naive patients with advanced-stage non-small-celllung cancer. J Clin Oncol. 2008 Jul 20;26(21):3543-51. doi:10.1200/JCO.2007.15.0375.
[4]Shukuya T, Yamanaka T, Seto T, et al. Nedaplatin plusdocetaxel versus cisplatin plus